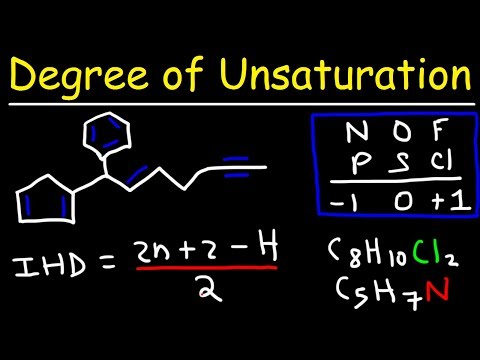
कार्बनिक अणुओं के आणविक सूत्र के विश्लेषण में, असंतृप्ति की डिग्री एक गणना है जो रिंगों और बांडों की कुल संख्या निर्धारित करती है। रासायनिक संरचना बनाने में मदद करने के लिए कार्बनिक रसायन विज्ञान में एक सूत्र का उपयोग किया जाता है।
असंतृप्ति की मात्रा कैसे ज्ञात करते हैं?
असंतृप्ति की डिग्री की गणना (DU) [2C+2=(2x3)+2=8.] यौगिक को पूरी तरह से संतृप्त होने के लिए 4 और हाइड्रोजेन की आवश्यकता होती है (हाइड्रोजन की अपेक्षित संख्या-हाइड्रोजन की देखी गई संख्या=8-4=4)। असंतृप्ति की डिग्री 2 के बराबर है, या अणु को संतृप्त के रूप में वर्गीकृत करने के लिए हाइड्रोजन की संख्या का आधा है।
जैविक रसायन विज्ञान में असंतृप्ति की डिग्री क्या है?
कार्बनिक अणुओं के आणविक सूत्र के विश्लेषण में, असंतृप्ति की डिग्री (जिसे हाइड्रोजन की कमी का सूचकांक (IHD), दोहरे बंधन समकक्ष, या असंतृप्ति सूचकांक के रूप में भी जाना जाता है) एक गणना है कि वलयों और बंधों की कुल संख्या निर्धारित करता है। …
असंतृप्ति की डिग्री 4 का क्या मतलब है?
उदाहरण: बेंजीन (असंतृप्ति की 4 डिग्री)
उदाहरण के लिए, इस प्रकार आणविक सूत्र C6H 6 (असंतृप्ति का 4 डिग्री) अणुओं से संतुष्ट होता है। 4 पीआई बांड। 3 पाई बॉन्ड और एक रिंग (बेंजीन) दो पाई बॉन्ड और दो रिंग (बहुत अस्थिर देवर बेंजीन, 1963 में संश्लेषित)
असंतृप्ति की डिग्री का 1/2 मतलब क्या है?
असंतृप्ति की एक डिग्री 1 रिंग या 1 डबल बॉन्ड (1 π बॉन्ड) के बराबर है। असंतृप्ति की दो डिग्री 2 डबल बॉन्ड, 1 रिंग और 1 डबल बॉन्ड, 2 रिंग, या 1 ट्रिपल बॉन्ड (2 बॉन्ड) के बराबर होती है।